Por: PhD (c) Joao De Souza Pacheco
El melón (Cucumis melo L.) principalmente se cultiva en las áreas tropicales y subtropicales. La fruta del melón es conocida por sus propiedades nutritivas y se recomienda para el tratamiento de enfermedades cardiovasculares; además, la pulpa del melón presenta una buena fuente de provitamina A y vitamina C. En Perú, el melón se cultiva en 10 de los 24 departamentos del Perú con un área aproximada de 1 176 hectáreas. Los departamentos de Loreto (38%), Ica (20,8%) y Lima (17,6%) poseen la mayor producción de este cultivo. Julio es el mes en donde se realiza la mayor siembra (24.8%), mientras que octubre es donde se realiza la mayor cosecha (23.8%) con 3398 TM.
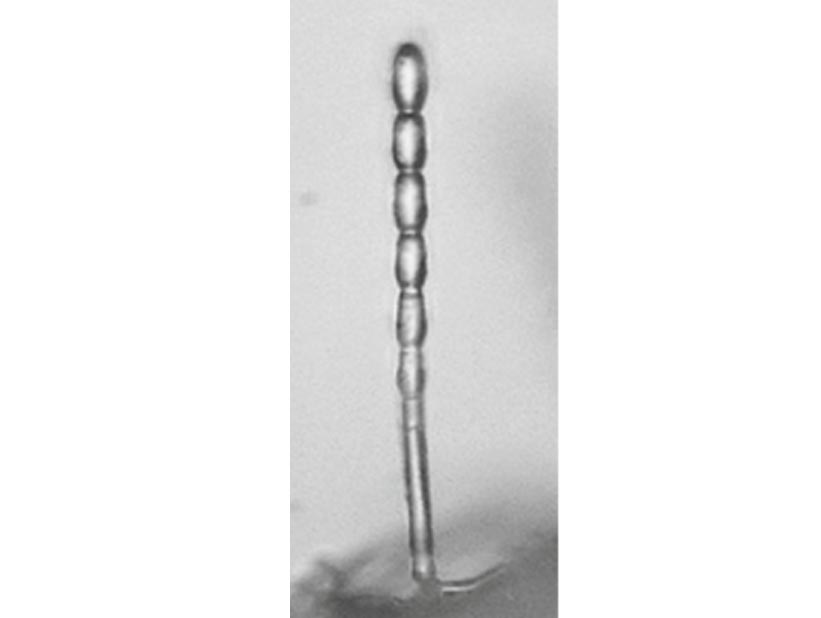
Los sistemas intensificados de cultivo han contribuido a una mayor incidencia de plagas y enfermedades. Entre las enfermedades que afectan a las cucurbitáceas, la oidiosis causa un daño significativo en el melón y se presenta en todo el mundo. Varias las especies del orden Erysiphales pueden causar esta enfermedad en dicha familia de plantas. En el melón, se ha reportado que la enfermedad es causada principalmente por dos especies: Podosphaera xanthii [anteriormente Sphaerotheca fuliginea (Schlecht) Pollacci] y Golovinomyces cichoracearum [anteriormente Erysiphe cichoracearum DC. Ex Mérat]. P. xanthii se presenta con mayor frecuencia en las regiones tropicales y subtropicales, mientras que G. cichoracearum se observa más en climas templados. Hay casi 50 razas fisiológicas identificadas y aproximadamente 36 fuentes de resistencia de la planta huésped en el melón. Estos hongos son biotróficos obligados. El micelio es normalmente ectofítico (crecimiento sobre la superficie). Las hifas presentan paredes finas, son flexuosas, en ocasiones rectas o geniculadas (hifa de la cual salen conidios provocando torceduras cada vez que nace uno), de 3-4 μm de ancho. Los estados asexuales de tanto P. xanthii como de G. cichoracearum producen conidios hialinos, elípticos, de paredes delgadas y nacen en cadena a partir de conidióforos cortos, que no se ramifican y crecen en ángulo recto desde la superficie de la hoja. No obstante, Perez et al. (2009) diferencia a estas especies por las dimensiones de sus conidias, reportando que los conidios de P. xanthii tienen dimensiones de 24-40 × 15-22 μm, los cuales presentan cuerpos de fibrosina bien desarrollados y visibles en preparaciones con KOH al 3%.; mientras que en G. cichoracearum estos cuerpos están ausentes. En su estado sexual, los cleistotecios (cuerpo fructífero cerrado que al madurar se rompe de forma irregular y libera las ascas) se desarrollan en la superficie de las hojas del hospedante. Los poco frecuentes cleistotecios que forma G. cichoracearum miden entre 80 y 140 μm, con apéndices sin ramificaciones y contienen de 10 a 15 ascas. En el caso de P. xanthii son esféricos o subesféricos, de paredes gruesas, pardos a pardo oscuros, entre 80 y 104 μm, con una sola asca y presentan apéndices hifoides septados, numerosos e insertados basalmente.
La enfermedad se distingue fácilmente por las características estructuras fúngicas como son el desarrollo de micelios y conidios blancos principalmente en hojas y tallos, pero también puede afectar frutos y estructuras florales. Dichas estructuras fúngicas blanquecinas se pueden desarrollar sobre ambas caras de las hojas. En las plantas severamente afectadas, las hojas pueden volverse cloróticas o incluso necróticas y quebradizas; llegando en algunos casos a haber una defoliación temprana. En consecuencia, disminuye el potencial fotosintético y, de esta forma, disminuye no sólo el rendimiento del cultivo, sino también la calidad de las frutas, ya que estos además pueden sufrir daños por escaldaduras. La infección en las etapas iniciales es perjudicial para la propia planta o puede reducir drásticamente el rendimiento de la fruta, mientras que la infección en las etapas posteriores generalmente reduce la calidad de la fruta. La enfermedad prospera en temperaturas moderadas y alta humedad, lo que generalmente hace que la atmósfera del invernadero sea más propensa a la enfermedad.
Como es una enfermedad transmitida a través del viento es difícil de controlar por el método cultural; sin embargo, es una buena práctica la eliminación de malas hierbas y restos de cultivo de campañas pasadas para evitar que posibles inóculos se mantengan en el campo. Otro tipo de control es el biológico, el cual es una herramienta que cada vez está siendo más utilizado debido a que el cultivo orgánico está obteniendo mayores réditos. De esta forma, Elad et al. (1998) evaluó los hongos Trichoderma harzianum y Ampelomyces quisqualis en el control de oídium en melón, en donde encontraron que Trichoderma harzianum, logró reducir notablemente los niveles de infección por mildiu polvoriento en hasta un 97% pero su control fue más eficiente en hojas jóvenes que en hojas viejas; sin embargo, A. quisqualis logró hasta un 98% de control además que conservó una capacidad de control significativa en las hojas más viejas. Del mismo modo, Romero et al. (2007) evaluaron Akanthomyces lecanii (anteriormente llamada Lecanicillium lecanii), A. quisqualis y Bacillus subtilis para controlar al oídium de cucurbitáceas, en donde encontraron que tuvieron mejores rendimientos a una humedad relativa de 90-95%. B. subtilis mostró una capacidad de control similar a la de compuestos químicos como el Azoxystrobin.
Si desea conocer los diferentes ensayos con nuestros productos biológicos realizados por nuestros desarrollistas, los invitamos a visitar nuestra sección de ensayos aqui.
REFERENCIAS
- Cohen, R. et al. (2004) Phytoparasitica, 32(2):174-183.
- Delgado G. y Lemus Y. (2004). Fitosanidad. 8(2):27-29.
- Elad, Y et al. (1998) BioControl 43:241-251.
- González, N., et al. (2010). Revista de Protección Vegetal, 25(1), 44-50.
- Huang, X. Q., et al. (2000) Theor. Appl. Genet. 101:407-414.
- Ivanova PH. (2012) The melons-Raw material for food processing. En: 50 years Food RDI International Scientific-Practical Conference “Food, Technologies and Health” Proceeding Book. Plovdiv, Bulgaria, 23-26.
- Keinath, A. P. y Dubose, V. B. (2004) Crop Prot. 23:35-42.
- Kuzuya, M. et al. (2006) Journal of Experimental Botany, 57(9):2093-2100.
- Laur LM y Tian L. (2011) J. Food Compos. Anal. 24:194–201.
- Lebeda, A. et al. (2016) European Journal of Plant Pathology, 144(2): 399-410.
- McCreight, J. D. (2006) Journal of the American Society for Horticultural Science, 131(1): 59-65.
- McGrath, M T. (2017) Powdery mildew. En: Keinath, A.P. et al. (Eds.) Compendium of cucurbit diseases and insect pests. 2da ed. St. Paul. APS Press.
- Naruzawa, E.S. et al. (2011) Summa Phytopathologica, 37(2): 94-100.
- Obregón, V. G. (2017). Guía para la identificación de las enfermedades de las cucurbitáceas. INTA (Argentina).
- Pérez-García A, et al. (2009) Molecular Plant Pathology, 10(2):153-160.
- Rabelo, H. D. O., et al. (2017). Pesquisa Agropecuária Tropical, 47: 440-447.
- Romero D et al. (2007) Plant Pathology 56: 976-986.
- SIEA – Sistema Integrado de Estadística Agraria. Calendario de siembras y cosechas. Ministerio de Agricultura y Riego del Perú, 2014-2019. Disponible en: http://siea.minagri.gob.pe/portal/calendario/.
- Stadnik, M. et al (2001) Oídios de cucurbitáceas. En: Stadnik, M. et al (Eds) Oídios. Jaguariuna: Embrapa Meio Ambiente